重点知识:
1.原子由原子核和核外电子构成,原子核由质子和中子构成。2.在原子中:核电荷数=质子数=核外电子数。3.质量数(A)=质子数(Z)+中子数(N)。4.元素指具有相同质子数(核电荷数)的同一类原子的总称。5.核素指具有一定数目质子和一定数目中子的一种原子。6.不同元素具有的核素种类不同,同一种元素不同的核素之间互为同位素,其化学性质相同。7.质子数决定元素种类,质子数和中子数共同决定核素种类。
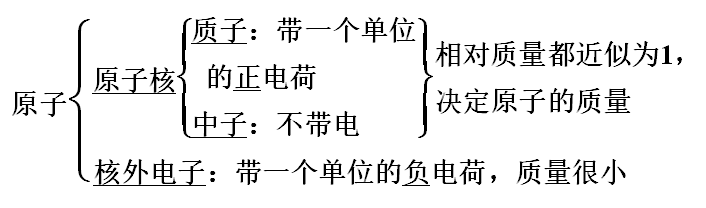
一、原子的构成
1.原子及构成的微粒
2.质量数
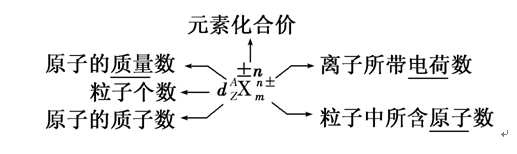
3.原子构成的表示
4.原子结构中的微粒关系(1)原子质量数=中子数+质子数质子数=核外电子数=核电荷数(2)离子的核外电子数
[特别提醒](1)原子中不一定含有中子,且中子数不一定等于质子数,如H。(2)同种元素的原子与其相应离子的质量数相等,如23Na与23Na+。5.练习1.判断正误(正确的打“√”,错误的打“×”)。(1)所有的原子中都含有质子和中子(×)(2)34S原子核内中子数为16(×)(3)2H+核外电子数为2 (×)(4)13C和15N核内中子数相差1(√)(5)H3O+和OH-中具有相同的质子数和电子数(×)(6)质量数就是元素的相对原子质量(×)2.中国科学技术名词审定委员会已确定第116号元素Lv的名称为。关于Lv的叙述错误的是( )A.质子数116 ???????????????????? B.中子数177C.核外电子数116??????????????????????????? D.相对原子质量293解析:选D A.元素符号左下角表示的是原子核内的质子数,该元素的质子数是116,正确。B.元素符号左上角表示的是该元素原子的质量数,质量数是质子数与中子数的和,所以该原子的中子数是293-116=177,正确。C.对于元素的原子来说,原子核内的质子数等于原子核外的电子数,该原子的原子核外电子数是116,正确。D.293只表示该元素的一种原子的质量数而不是该元素或原子的相对原子质量,错误。
二、核素
1.概念辨析
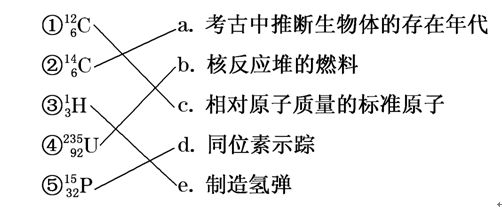
[特别提醒](1)相同存在形态的同位素,化学性质几乎完全相同,物理性质不同。(2)元素的种类少于核素的种类。2.几种常见的同位素(1)氢元素的三种核素:
| 俗称 | - | 重氢 | 超重氢 |
| 符号 | H | D | T |
| 质子数 | 1 | 1 | 1 |
| 中子数 | 0 | 1 | 2 |
(2)核素与其用途:
3.练习1.判断正误(正确的打“√”,错误的打“×”)。(1)O2和O3、红磷和白磷均互称同位素(×)(2)同位素原子的物理、化学性质均完全相同(×)(3)一种单质中可能含有多种核素,如O2中含16O、17O、18O三种核素(√)(4)H+、H+和H+互称同位素(×)(5)同位素之间的转化属于化学变化(×)(6)质子数相同的粒子一定属于同一种元素(×)2.“玉兔”号月球车用Pu作为热源材料。下列关于Pu的说法正确的是( )A.Pu与U互为同位素B.Pu与Pu互为同素异形体C.Pu与U具有完全相同的化学性质D.Pu与Pu具有相同的最外层电子数解析:选D A.Pu与U的质子数不同,不能互为同位素,错误;B.Pu与Pu均是核素,不是单质,不能互为同素异形体,错误;C.Pu与U的质子数不同,属于不同的元素,不可能具有完全相同的化学性质,错误;D.Pu与Pu的质子数相同,具有相同的最外层电子数,正确。3.(1)在6Li、7Li、23Na、24Mg、14C、14N六种粒子中,包含________种元素,________种核素,其中互为同位素的是________,中子数相等的核素是__________。(2)D3O+中的质子数为__________,电子数为________,中子数为________。答案:(1)5 6 6Li与7Li 23Na与24Mg(2)11 10 11





 宁公网安备 64010602000385号
宁公网安备 64010602000385号
发表评论