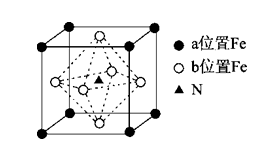
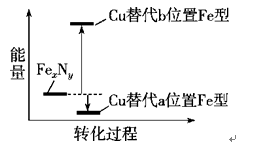
21.[2017·江苏卷] 【选做题】本题包括A、B两小题,请选定其中一小题,并在相应的答题区域内作答。若多做,则按A小题评分。 A.[物质结构与性质] 铁氮化合物(FexNy)在磁记录材料领域有着广泛的应用前景。某FexNy的制备需铁、氮气、丙酮和乙醇参与。 (1)Fe3+基态核外电子排布式为________。 (2)丙酮(CH3CCH3O)分子中碳原子轨道的杂化类型是______________,1 mol丙酮分子中含有σ键的数目为________。 (3)C、H、O三种元素的电负性由小到大的顺序为________。 (4)乙醇的沸点高于丙酮,这是因为____________________________________。 (5)某FexNy的晶胞如图1所示,Cu可以完全替代该晶体中a位置Fe或者b位置Fe,形成Cu替代型产物Fe(x-n)CunNy。FexNy转化为两种Cu替代型产物的能量变化如图2所示,其中更稳定的Cu替代型产物的化学式为___________。
图1 FexNy晶胞结构示意图
图2 转化过程的能量变化
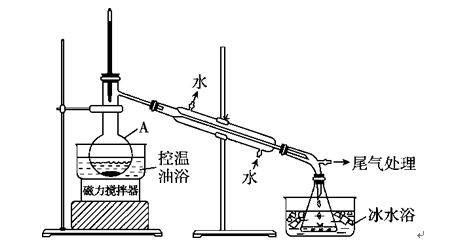
B.[实验化学] 1?-溴丙烷是一种重要的有机合成中间体,沸点为71 ℃,密度为1.36 g·cm-3。 实验室制备少量1?-溴丙烷的主要步骤如下: 步骤1: 在仪器A中加入搅拌磁子、12 g正丙醇及20 mL水,冰水冷却下缓慢加入28 mL浓H2SO4;冷却至室温,搅拌下加入24 g NaBr。 步骤2:如图所示搭建实验装置,缓慢加热,直到无油状物馏出为止。
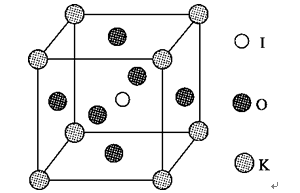
步骤3:将馏出液转入分液漏斗,分出有机相。 步骤4:将分出的有机相转入分液漏斗,依次用12 mL H2O、12 mL 5%Na2CO3溶液和12 mL H2O洗涤,分液,得粗产品,进一步提纯得1?-溴丙烷。 (1)仪器A的名称是________;加入搅拌磁子的目的是搅拌和________。 (2)反应时生成的主要有机副产物有2?溴丙烷和________。 (3)步骤2中需向接受瓶内加入少量冰水并置于冰水浴中的目的是________。 (4)步骤2中需缓慢加热使反应和蒸馏平稳进行,目的是___________。 (5)步骤4中用5% Na2CO3溶液洗涤有机相的操作:向分液漏斗中小心加入12 mL 5% Na2CO3溶液,振荡,____________,静置,分液。 21.A.[物质结构与性质](1)[Ar]3d5或1s22s22p63s23p63d5? (2)sp2和sp3 9 mol (3)H<C<O? (4)乙醇分子间存在氢键? (5)Fe3CuN [解析] (1)Fe3+基态核外电子排布式为[Ar]3d5。(2)一个丙酮分子中有两个甲基和一个羰基,甲基中碳原子为sp3杂化,羰基中碳原子为sp2杂化;一个丙酮分子中有6个碳氢键、2个碳碳单键和1个碳氧双键(1个σ键和一个π键) ,所以1 mol丙酮分子中含有9 mol σ键。(3)C、H、O三种元素的电负性由小到大的顺序为H<C<O。(4)乙醇分子间容易形成氢键,所以乙醇的沸点高于丙酮。(5)物质本身所含能量越低越稳定,所以更稳定的Cu替代型产物为Cu替代a位置Fe型,则根据均摊法,一个晶胞中,Cu原子个数为8×(八分之一)=1,Fe原子个数为6×(二分之一)=3,N原子个数为1,所以化学式为Fe3CuN。 B.[实验化学](1)蒸馏烧瓶 防止暴沸? (2)丙烯、正丙醚? (3)减少1?-溴丙烷的挥发? (4)减少HBr挥发? (5)将分液漏斗下口向上倾斜、打开活塞排出气体 [解析] (1)仪器A为蒸馏烧瓶,加入搅拌磁子的目的是搅拌和防止暴沸。(2)正丙醇在反应过程中,除了发生取代反应生成卤代烃,还可能发生消去反应和分子间脱水,分别生成丙烯和正丙醚。(3)? 冰水浴是降低温度,根据信息,1?-溴丙烷的沸点为71 ℃,所以为减少1?-溴丙烷挥发,应将接受瓶置于冰水浴中。(4)蒸馏瓶中的反应原理是NaBr与浓硫酸反应生成HBr,HBr与正丙醇发生取代反应生成1?-溴丙烷,所以缓慢加热的目的是防止生成的HBr挥发。 35.[2017·全国卷Ⅰ] [化学——选修3:物质结构与性质]钾和碘的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题: (1)元素K的焰色反应呈紫红色,其中紫色对应的辐射波长为________(填标号)nm。 A.404.4? B.553.5? C.589.2? D.670.8? E.766.5 (2)基态K原子中,核外电子占据最高能层的符号是____________,占据该能层电子的电子云轮廓图形状为________。K和Cr属于同一周期,且核外最外层电子构型相同,但金属K的熔点、沸点等都比金属Cr低,原因是______________________________________________。 (3)X射线衍射测定等发现,I3AsF6中存在I离子。I离子的几何构型为____________,中心原子的杂化形式为________________。 (4)KIO3晶体是一种性能良好的非线性光学材料,具有钙钛矿型的立体结构,边长为a=0.446 nm,晶胞中K、I、O分别处于顶角、体心、面心位置,如图所示。K与O间的最短距离为______nm,与K紧邻的O个数为______。
(5)在KIO3晶胞结构的另一种表示中,I处于各顶角位置,则K处于________位置,O处于________位置。
35.(1)A? (2)N 球形 K原子半径较大且价电子数较少,金属键较弱
(3)V形 sp3? (4)0.315 12? (5)体心 棱心
[解析] (1)紫色波长在400 nm~430 nm间,因此结合选项知A项正确。(2)基态K原子的价层电子排布式为4s1,故其核外电子占据最高能层为第四层,其能层的符号是N;因最后一个电子填充在s轨道(能级)上,其电子云轮廓图为球形;K和Cr虽属于同一周期,且核外最外层电子构型相同,但因金属K的原子半径较大且价电子数较少,金属键较弱,故K的熔点、沸点等都比金属Cr低。(3)在I中中心原子I的价层电子对数为4(其中2个σ键、2个孤电子对),因此其轨道杂化类型为sp3杂化,但离子的空间几何构型同水分子一样为V形。(4)利用晶胞结构可知,晶胞中K与O间的最短距离为晶胞面对角线的一半,即(二分之根号二)×0.446 nm;由晶胞易知,在同一平面内,与K紧邻的O个数为4,故在晶胞中与K紧邻的O个数为4×3=12。(5)根据KIO3的化学式,以及晶胞结构可知,若I处于各顶角位置,则该晶胞中K处于体心,O处于棱心。


 宁公网安备 64010602000385号
宁公网安备 64010602000385号
发表评论