1.核外电子排布规律(1)核外电子排布规律(a)能量规律:离核由近到远,电子能量由低到高。(b)数量规律:①每层最多容纳电子数为2n2(n为电子层数)(2n的2次方,博客显示不出来)。②最外层电子数不超过8(K层为最外层时不超过2)。③次外层电子数不超过18。注意:(a)电子层序数与符号的关系
| 电子层序数 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 电子层符号 | K | L | M | N | O | P | Q |
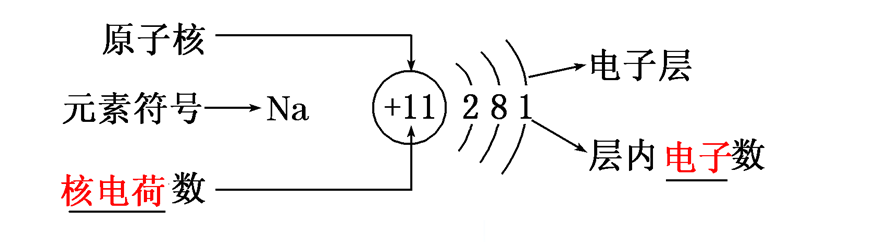
(b)电子能量大小关系:Q>P>O>N>M>L>K。(2)原子结构示意图
氯离子结构示意图为:
[特别提醒](1)原子结构示意图与离子结构示意图的比较
| 微粒 | 原子 | 阳离子 | 阴离子 |
| 结构 | 质子数=电子数 | 质子数>电子数 | 质子数<电子数 |
| 电性 | 不显电性 | 带正电 | 带负电 |
| 最外层电子 | 不一定是8 | 一定是8(锂离子为2) | (H-为2) 一定是8 |
| 化学性质 | 不一定稳定 | 相对稳定 | 相对稳定 |
(3)课堂练习:对于核电荷数1~18的元素,根据核外电子排布规律填空:(1)最外层电子数为1的原子有__________、________、________。(2)最外层电子数为2的原子有__________、________、________。(3)最外层电子数跟次外层电子数相等的原子有________、________。(4)最外层电子数是次外层电子数2倍的原子是________。(5)最外层电子数是次外层电子数3倍的原子是________。(6)最外层电子数是次外层电子数4倍的原子是________。(7)次外层电子数是最外层电子数2倍的原子有________、________。(8)内层电子总数是最外层电子数2倍的原子有________、________。(9)电子层数跟最外层电子数相等的原子有__________、________、________。(10)电子层数是最外层电子数2倍的原子是________。(11)最外层电子数是电子层数2倍的原子有________、________、________。(12)最外层电子数是电子层数3倍的原子是________。答案:(1)H Li Na (2)He Be Mg (3)Be Ar(4)C (5)O (6)Ne (7)Li Si (8)Li P(9)H Be Al (10)Li (11)He C S (12)O2.原子结构与元素性质的关系(1)原子结构与元素性质的关系元素的性质与原子的核外电子排布密切相关,元素的化学性质主要决定于原子的最外层电子排布,元素的化合价的数值也与原子的电子层结构特别是最外层电子数有关。1.金属元素原子最外层电子数一般小于4(填“大于”“小于”或“等于”),较易失去电子,化合价常显正价,单质表现还原性。2.非金属元素原子最外层电子数一般大于或等于4(填“大于”“小于”或“等于”),通常易得到电子,在化合物中化合价常显负价,单质大部分表现氧化性。(2)思考发现1.原子最外层电子数小于4一定是金属元素吗?提示:不一定是金属元素,如非金属元素H、He、B等最外层电子数分别为1、2、3。2.原子结构与元素的性质有何关系?提示:当原子最外层电子数小于4时,在化学反应中易失去电子表现出还原性;当原子最外层电子数大于4小于8时,在化学反应中易得到电子表现出氧化性。?(3)原子结构与元素性质、元素化合价的关系
| 原子类别 | 与元素性质的关系 | 与元素化合价的关系 |
| 稀有气体 | 最外层电子数为8(He为2),结构稳定,性质不活泼 | 原子结构为稳定结构,常见化合价为零 |
| 金属元素原子 | 最外层电子数一般小于4,较易失去电子 | 易失去最外层电子,达到稳定结构,其最高正价为+m(m为最外层电子数) |
| 非金属元素原子 | 最外层电子数一般大于或等于4,较易获得电子,形成8电子稳定结构 | 得到一定数目的电子,达到稳定结构,其最低负价为m-8(H为m-2) |
(4)课堂练习1.判断正误(正确的打“√”,错误的打“×”)。(1)最外层电子数为2的原子一定是金属元素(×)(2)最外层电子数大于4的原子一定是非金属元素(×)(3)不容易得电子的原子一定容易失电子(×)(4)O原子的最外层电子数为6,故其最高正价为+6(×)(5)金属原子只有还原性(√)2.以下是四种粒子的结构示意图。
(1)上述粒子中氧化性最强的是________(填字母),写出一个它表现氧化性的化学方程式:________________________________________________________________________。(2)上述粒子中还原性最强的是________(填字母),写出一个它表现还原性的化学方程式:________________________________________________________________________。(3)电子层结构与C相同、化学性质最稳定的元素,原子的核电荷数是________,用原子结构与元素性质的关系说明它化学性质稳定的原因____________________________________________________________________________________________________。(4)A的一种同位素可用于考古断代,这种同位素的符号是________,这种用途取决于它的________性。解析:A→D四种粒子依次为C、F、Na+、Al3+。粒子氧化性最强即得电子能力最强,粒子还原性最强即失电子能力最强。答案:(1)B 2F2+2H2O===4HF+O2(合理即可) (2)A C+CO2高温,2CO(合理即可)(3)10 原子最外层为8电子稳定结构,不易得失电子,性质稳定(4)
放射3.“等电子”微粒的判断与应用(1)常见“2电子”微粒He、H-、Li+、Be2+(2)常见“10电子”微粒(a)阳离子:Na+、Mg2+、Al3+、NH、H3O+。(b)阴离子:N3-、O2-、F-、OH-、NH。(c)分子:Ne、HF、H2O、NH3、CH4。(3)常见“18电子”微粒(a)阳离子:K+、Ca2+。(b)阴离子:P3-、S2-、HS-、Cl-。(c)分子:Ar、HCl、H2S、PH3、SiH4、F2、H2O2等。(4)核外电子总数及质子总数均相同的微粒(a)Na+、H3O+、NH; (b)F-、OH-、NH;(c)Cl-、HS-; (d)N2、CO、C2H2等。(5)课堂练习







 宁公网安备 64010602000385号
宁公网安备 64010602000385号
发表评论